Über den Bergknappweiher: Die vier Jahreszeiten
die geografische lage des torfstiches
Der Bergknappweiher (47°51’9.99''N,
11°14’18''E)
liegt in der voralpinen Region in
Bayern (Deutschland), etwa 50 km
südwestlich von München.
Der Teich befindet sich nahe der für
den Bayerischen Raum sehr bekannten Seen, dem Ammersee
S
und dem
Starnberger See. Der Bergkappweiher liegt nur etwa 15 km
bzw. 6 km von diesen entfernt. Der Teich entstand durch das
Stechen von Torf, ist demzufolge ein Torfstich.
der dystrophe charakter und die jahreszeitliche entwicklung des phytoplanktons
 Cyanobakterien im
Bergknappweiher, 2001:
Cyanobakterien im
Bergknappweiher, 2001:
Die Aufrahmung von Cyanobakterien an der Wasseroberfläche des
dystrophen Teiches wird hier für den Herbst gezeigt und besteht vor
allem aus Bündeln von Aphanizomenon
flos-aquae. Microcystis-
und Anabaena-Taxa
sind hier die
weniger häufig vertretenen Cyanobakterien.
Der Teich wird in Hinblick auf
die vier Jahreszeiten in der
Galerie gezeigt.
Er ist ein Moorteich
(dystropher Teich), was bedeutet, dass das Wasser
hohe Konzentrationen von
gelöstem organischem Kohlenstoff (DOC)
enthält. DOC verursacht die gelb-bräunliche
Wasserfärbung (siehe Foto 8
in der obigen Galerie). Diese Wasserfarbe, oder besser gesagt, der hohe
DOC-Gehalt sind allerdings völlig unbedenklich für Badende im
Torfstich. Im
Gegenteil: Ein Wasser mit hohem DOC-Gehalt filtert UV viel stärker aus
dem Wellenspektrum heraus, als ein vergleichsweise klares Teich- oder
Seewasser.
Der Einfluss von UV auf einen Klarwassersee im alpinen Raum lässt sich
hier kurz beispielhaft für den Vierwaldstättersee
ausführen. Der See
liegt 454m über dem Meeresspiegel in den Schweizer Alpen und zeigt
deutlich, dass die Photosynthese der Primärproduzenten in der obersten
Wasserschicht von 5 m an einem sonnigen Tag durch UV gehemmt
ist (siehe
Abb.2
in Teubner et al.
2001 R).
Messung der Photosynthese an der Wasseroberfläche in 0 und 2 m
Tiefe im Vierwaldstättersee zeigen, dass Wasserproben, die von dem
UV-A-Teil des Spektrums abgeschirmt wurden, viel höhere
photosynthetische Raten erreichten, als Proben der gleichen Wassertiefe
aber ohne UV-Schutz.
Es ist weiter anhand des vertikalen Profils der
Photosyntheserate in dem alpinen See ersichtlich, dass die hemmende
Wirkung von UV ab 2 m mit der Wassertiefe deutlich abnimmt. In
einer Tiefe von ca.
5 m sind die photosynthetischen Raten von UV-geschützten und
nicht
geschützten Proben etwa gleich. Der Bergknappweiher befindet sich in
der voralpinen Region
bei etwa
617 m über dem Meeresspiegel,
und ist
damit sogar leicht höher als der Vierwaldstätter See gelegen. Es lässt
sich dennoch aufgrund des UV-Schutzschildes durch das gelb gefärbte
Wasser
vermuten, dass hier – anders als im Vierwaldstätter See - die
Primärproduktion selbst nahe der Teichoberfläche keine UV-Hemmung
aufweist. Es kann ansonsten allgemein davon ausgegangen werden, dass
der Einfluss
von UV auf das aquatische Leben in Gewässern im Alpenraum um so größer
wird (z.B. werden physiologische Anpassungsstrategien sichtbar), je
höher der Standort des Gewässers gelegen ist und
wenn das Wasser zugleich einen niedrigen DOC-Gehalt aufweist.
Im Bergknappweiher, ist die hohe Konzentration von DOC im wesentlichen
durch eingeschwemmte „alte“ Huminstoffe
bedingt, die natürlicher Weise
die wesentlichen organische Bestandteile der Böden darstellen („frisch“
gebildetes DOC kann auch in einem Gewässer vorkommen und wird zum
Beispiel durch die im Wasser lebenden Algen ins Wasser abgegeben).
Der hohe DOC-Gehalt im Bergknappweiher ist daher durch die Umgebung und
den Untergrund des Teiches bedingt. Der Teich wurde durch Torfabbau
geschaffen und ist auch heute noch von torf- und humushaltigen Böden
der Wiesen und Waldflächen umgeben. Die Wiesen sehen zum Teil
trockengelegt aus
und werden heute hauptsächlich als Weideland für Rinder oder einfach
zur Heuernte verwendet. Die nachhaltige
Viehwirtschaft in dieser Region
wird näher auf der Webseite zum Ammersee
S,
die der alpinen Region
„Salzkammergut“ in Österreich auf der Seite vom Attersee
S
näher illustriert.
 Bergknappweiher, 2001:
Bergknappweiher, 2001:
Wiesen und Wälder liegen rund um den Teich.
.
 Bergknappweiher, 2001:
Bergknappweiher, 2001:
Bultförmige Tuffs von Groß-Seggenarten (Carex
acutiformis/riparia)
sind hier noch als kleine Pflanzen im Frühjahr am Ufer vom Teich zu
sehen.
 Am Ufer vom Bergknappweiher, 2001:
Am Ufer vom Bergknappweiher, 2001:
Dieses Foto zeigt eine asphaltierte Agrarstraße, die unmittelbar an dem
Ufer des Teiches entlang führt. Die nachhaltige Tierhaltung in dieser
voralpinen Region in Bayern (Deutschland) ist näher auf der
Webseite über den Ammersee S
dargestellt. Die nachhaltige
Landwirtschaft im Alpenraum in Oberösterreich (Österreich) wird
ausführlicher auf der Webseite über den Attersee S
gezeigt.
 An den Bergknappweiher angrenzende
Agrar-Dorflandschaft, 2001:
An den Bergknappweiher angrenzende
Agrar-Dorflandschaft, 2001:
Kleine Teiche entstanden in dieser Region meist durch Torfabbau. Der
Teich, der auf dem Foto zu sehen ist, liegt in unmittelbarer
Nachbarschaft zum Bergknappweiher. Ein Entwässerungsgraben durch die
Wiese ist auch zu sehen.
Pflanzen wachsen, blühen und fruchten und somit wechselt das Erscheinungsbild der Wiesen und Wäldern im Laufe eines Jahres. Doch nicht nur die Pflanzen- und Tiergemeinschaften um ein Gewässer, sondern auch die Gemeinschaften aquatischer Mikroorganismen im Wasserbecken ändern sich mit den Jahreszeiten. Die jahreszeitlichen Veränderungen sind dabei in der Regel nicht zufällig, sondern folgen einem Muster, welches im Einklang mit dem jahreszeitlichen Zyklus der Umweltbedingungen steht. Der Schwerpunkt dieser Website hier ist es, das saisonale Muster der Phytoplanktonentwicklung in einem flachen Wasserbecken zu veranschaulichen. Dies wird im folgenden Absatz näher beschrieben.
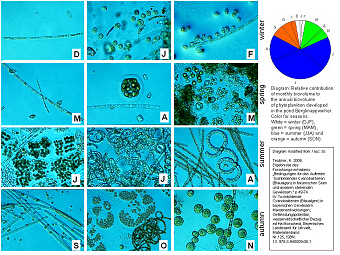 Phytoplankton im
Bergknappweiher,
2000/2001:
Phytoplankton im
Bergknappweiher,
2000/2001:
Saisonale Entwicklung des Biovolumens vom Phytoplankton, beobachtet für
den
Zeitraum von Dezember 2000 bis November 2001. Die Fotos sind
DIK-Aufnahmen mit einem Lichtmikroskop (DIK = Differentieller
Interferenzkontrast). Die Grafik auf der rechten Seite zeigt den
relativen Anteil monatlicher Biovolumina am jährlichen Biovolumen des
Phytoplanktons für den betrachteten Zeitraum. Die Jahreszeiten sind in
Weiß für den Winter, grün für den Frühling, für den Sommer blau und
orange für den Herbst markiert.
Die Abbildung linksseitig zeigt die monatliche
Änderung der
Artenzusammensetzung
und Biovolumenentwicklung des Phytoplanktons über ein Jahr. Das
niedrigste Phytoplankton-Biovolumen wird für die Winterzeit gemessen
(siehe kleine weiße Fläche in der kreisförmigen Grafik). Einige
Kieselalgen (z.B. ist die Kieselalge Aulacoseira
auf den mikroskopischen Fotos für den
Winter linksseitig mehrfach zu sehen) und einzellige begeißelte
Grünalgen kommen beispielsweise in der in der kalten Jahreszeit vor.
Mit
zunehmender Tageslänge wachsen und teilen sich die Zellen des
Phytoplanktons. Das Biovolumen erreicht schnell einen Spitzenwert im
zeitigen
Frühjahr. Wenn
man allein die kühle Jahreszeit vom frühen Herbst bis zum späten
Frühling betrachtet (September bis Mai) können die höchsten Biovolumina
im März entwickelt werden, da zu diesem Zeitpunkt im Jahr ausreichend
Nährstoffe für ein unbegrenztes Wachstum vorhanden sind. Die Nährstoffe
haben sich über die kalte Jahreszeit angesammelt und liegen nun entlang
der gesamten Wassersäule gut verteilt vor (bei der
Frühjahrs-Vollzirkulation wird der Wasserkörper gut durchmischt). Diese
Nährstoffe können nun unter den günstigen Wetterbedingungen im Frühjahr
von den
Phytoplankton-Organismen gut zum Wachstum genutzt werden. So
zeichnet sich im Frühjahr ein exponentielles
Wachstum, d.h. ein rasantes
Wachstum, von
schnellwüchsigen, kleinen, einzelligen
Phytoplanktonarten ab. Im Bergknappweiher zählen zu diesen
Formen die kleinen
zentrischen
Kieselalgen, die nadelförmigen Kieselalgen und die kleinen Grünalgen
und Cryptophyten. Die Dominanz der kleinzelligen
Arten im Frühjahr lässt sich an den hohen Werten für das Verhältnis von
Zell-Oberfläche zu Zell-Volumen ablesen (siehe Dynamik dieses
Verhältnises in den Flußseen, auf der Webseite Großer
Müggelsee
S
beschrieben).
Einige
Wochen später, im April, ist das Phytoplankton-Biovolumen wiederum
bemerkenswert niedrig. Zu diesem Zeitpunkt ist fast die niedrigste
Biomasse an Phytoplankton im Jahr vorhanden, wie sich leicht in dem
Kreisdiagramm ablesen lässt. Dieses geringe Phytoplankton-Biovolumen
ist das Resultat einer intensiven Beweidung
durch das Zooplankton. Das
Wachstum von Zooplanktonorganismen hängt viel stärker von der
Temperatur ab als jenes der photosynthetischen Planktonorganismen, also
dem Phytoplankton. Da es eine zeitliche Verschiebung zwischen der
Zunahme der Tageslänge (Wachstumssignal Licht für das Phytoplankton)
und dem
Anstieg der WASSER-Temperatur (Signal für den Beginn der Entwicklung
des Zooplanktons) im Jahresverlauf gibt, „hinkt“ die Entwicklung des
Zooplanktons der Entwicklung des Phytoplankton hinterher. Man könnte es
auch anders herum formulieren: „Es läuft die Phytoplanktonentwicklung
der Zooplanktonentwicklung im Frühjahr davon“ (siehe auch zeitliche
Verzögerung der maximalen Jahreswerte für die Temperatur und Ereignisse
der Seenphysik und Seenbiota auf den Seiten über den Mondsee
S
und den Ammersee
S).
Nach der Beweidung des Phytoplanktons nimmt auch die Zahl
der Zooplanktonorganismen wegen Futtermangel wieder ab. In dieser
kurzen Phase, in der sich nur noch sehr wenige biotische
Schwebepartikel in der Wassersäule befinden, d.h. wenn fast kein
Phytoplankton und quasi auch kein Zooplankton mehr vorhanden ist, liegt
eine hohe Durchsichtigkeit des Wasserkörpers vor. Diese Phase hält
wenige Tage bis etwa eine Woche an und wird als „Klarwasserstadium“
bezeichnet. Im Mai wachsen und vermehren sich die Phytoplanktonarten
erneut gut, nur ist jetzt die Artenzusammensetzung nicht mehr mit der
im zeitigen Frühjahr zu vergleichen. Im Phytoplankton vom
Bergknappweiher herrschen jetzt groß-zellige Kieselalgen und große
Kolonien der Grünalgen (Coenochloris
spec.) vor. Im
Sommer, d.h. in der
Zeit von Juni bis August, werden der Großteil, nämlich etwa 70%, des
jährlichen Phytoplankton-Biovolumens im Bergknappweiher gebildet.
Dieser
große Biovolumenanteil wird durch die große blaue Fläche im
Kreisdiagramm veranschaulicht. Der Monat mit der höchsten
Biovolumenentwicklung ist hier der Juli. Im Sommer setzt sich das
Biovolumen hauptsächlich aus Cyanobakterien zusammen. Es soll dabei
hervorgehoben werden, dass der Anteil der Arten oder Taxa innerhalb
einer Gruppe, wie der Gruppe der Cyanobakterien, sich durchaus
beträchtlich von Monat zu Monat ändern kann. So sind im Bergknappweiher
im Juni einige chroococcale Cyanobakterien der Gattung Microcystis
vorherrschend (u.a. M. viridis),
während im Juli und August die
filamentösen Formen der Cyanobakterien wie Anabaena
spp. und Aphanizomenon
flos-aquae vermehrt auftreten. Für viele der auf diesen
Fotos gezeigten
Cyanobakterien ist bekannt, dass sie Toxine produzieren können. Die im
Sommer auftretenden Cyanobakterien des Bergknappweihers bilden große
Kolonien und sind aus vielen Gründen meist nicht die bevorzugte Nahrung
für das Zooplankton. Aufgrund der geringen Tiefe wird das Teichwasser
selbst über den Sommer gelegentlich gut durchmischt. Die herbstliche
Vollzirkulation infolge von Herbststürmen spielt daher für die
Einmischung von Nährstoffen aus der Tiefe nahe der
Sediment-Wasserzone keine wesentliche Rolle. Es wird damit auch keine
herbstliche
Phytoplankton-Massenentwicklung, wie es in manch anderem stehenden
Gehwässer typisch ist, erwartet. Anders als im Frühjahr, wo sich die
Entwicklung des Phytoplanktons nicht gleichmäßig von Monat zu Monat
aufbaut, nimmt das Biovolumen des Phytoplanktons im Herbst sukzessive
ab. Cyanobakterien, die im Spätsommer dominant waren, sind auch im
Herbst noch
vertreten (siehe auch die ähnliche Zusammensetzung des Phytoplanktons
für die Periode Sommer/Herbst bzw Winter/Frühjahr in Flußsee,
beschrieben auf der Webseite zum Großen
Müggelsee S
beschrieben).
Wie auf dem mikroskopischen Foto für die
September-Probe zu sehen ist, bildet Aphanizomenon flos-aquae bereits
Ruhestadien, um so die kalte Jahresperiode gut zu überdauern. Anhand
des Bergknappweihers hat sich damit beispielhaft gezeigt, dass die
Entwicklung des Phytoplanktons dynamisch innerhalb eines Jahres
verläuft. Wie viele Proben zu welchem Zeitpunkt sollten im Verlauf
eines Jahres genommen werden, um solche ein Ökosystem grob einschätzen
zu können? Ist eine Probe pro Jahr ausreichend? Oder ist mehr Aufwand
notwendig und sollten es dann mindestens zwei oder vier bzw. sechs
Probenahmen im
Jahr sein, um eine zuverlässige Beurteilung eines solchen
Gewässers zu ermöglichen? In der Wissenschaft, in den Behörden, aber
auch bei den Schwimmteichbauern stellt sich oft die Frage, wie viele
Proben
sinnvoll und notwendig sind. Je nach Fragestellung und ob ein
natürliches Gewässer oder ein Schwimmteich untersucht werden soll, kann
die Zahl der notwendigen
Probenahmen durchaus unterschiedlich
ausfallen. Einige
Aspekte zur
Beprobung eines tiefen Sees mit einem Tiefen-Chlorophyll-Maximum werden
auf der Webseite über den Mondsee
S
diskutiert. Einige weitere Informationen
über allgemeine Muster der saisonalen Entwicklung des Phytoplanktons
und der jahreszeit-bedingten Verfügbarkeit von Nährstoffen werden auf
den Webseite über den Großen
Müggelsee S
beschrieben.
Anhand des Bergknappweihers konnte hier beispielhaft gezeigt werden,
dass ein flacher Teich über weite Zeiträume im Jahr d.h. vom späten
Frühjahr bis in den zeitigen Herbst, durch Aufrahmungen von
Cyanobakterien an ruhigen Tagen gekennzeichnet sein
kann.Cyanobakterien
können jedoch nicht nur an der Wasseroberfläche
aufrahmen, sondern sich auch im Gewässerkörper schwebend ausbreiten,
wodurch das Wasser grün gefärbt aussieht. Cyanobakterienblüten in
stehenden Gewässern sind kein Phänomen eines bestimmten Landes oder
einer Region, sondern treten weltweit auf. Sie sind oft die
Begleiterscheinung einer Nährstoffanreicherung in einem Gewässer.
Massenentwicklungen von Cyanobakterien werden auf dieser Website für
flache Seen wie die Alte Donau
S,
den Großen Müggelsee
S
&
und Langen See
S,
Taihu
S und
Poyang
Ssowie
für Teiche,
wie dem
Biotop Auersthal
S
beschrieben.
Cyanobakterienblüten können aber auch tiefen Seen
vorkommen. Dies wird hier beispielsweise für den Ammersee
S
und den Mondsee
S
ausgeführt.
Die saisonale Phytoplanktonentwicklung in einem
flachen Flußsee wird auf der Seite zum Großen
Müggelsee
S
näher
beschrieben.
hier zitierte Literatur zum Bergknappweiher
Leunert, F., Eckert, W., Paul, A., Gerhardt, V. & H.P. Grossart. 2014. Phytoplankton response to UV-generated hydrogen peroxide from natural organic matter. Journal of plankton research 36 (1): e104359. doi:10.1093/plankt/fbt096 OpenAccess
Leunert, F., Grossart, H. P., Gerhardt, V. & W. Eckert. 2013. Toxicant induced changes on delayed fluorescence decay kinetics of cyanobacteria and green algae: a rapid and sensitive biotest. PloS one 8(4): e63127. doi:10.1371/journal.pone.0063127 OpenAccess
Teubner, K.. 2006. Ergebnisse des Forschungsvorhabens „Bedingungen für das Auftreten toxinbildender Cyanobakterien (Blaualgen) in bayerischen Seen und anderen stehenden Gewässern." In: Toxinbildende Cyanobakterien (Blaualgen) in bayerischen Gewässern: Massenentwicklungen, Gefährdungspotential, wasserwirtschaftlicher Bezug. ed Ha Morscheid. Bayerisches Landesamt für Wasserwirtschaft Materialienband Nr. 125: p.49-74, München. ISBN: 13: 978-3-940009-08-1 Look-Inside OpenAccess / OpenAccess
Teubner, K., Morscheid, Ha., Tolotti, M., Morscheid, Hei. & V. Kucklentz. 2004. Bedingungen für das Auftreten toxinbildender Blaualgen in bayerischen Seen und anderen stehenden Gewässern. Bayerisches Landesamt für Wasserwirtschaft Materialien Nr. 113: 1–105, München. Look-Inside OpenAccess
Teubner, K. 2001. Algengemeinschaften in Seen. 83-112. In: Ökologie und Schutz von Seen. UTB Facultas, Wien. Look-Inside
Teubner, K., Sarobe, A., Vadrucci, M.R. & M. Dokulil. 2001. 14C photosynthesis and pigment pattern of phytoplankton as size related adaptation strategies in alpine lakes. Aquat Sci 63: 310-25. doi:10.1007/PL00001357 Look-Inside FurtherLink
Dokulil, M. & K. Teubner. 2000. Cyanobacterial dominance in lakes. Hydrobiologia 438: 1-12. Abstract FurtherLink
